Lange bevor Menschen von „Nanotechnologie“ sprachen, setzten sie diese bereits unbewusst ein. So wurde im antiken China durch das Verbrennen pflanzlicher Öle nanoskaliger Ruß gewonnen, um Tinten und Farben zu verbessern. Im Römischen Reich gab es Nanozusätze bei der Glasherstellung, um dieses zu färben. Ein weiteres Beispiel sind die sogenannten Damaszener Schwerte. Diese waren berühmt für die Härte ihrer Klingen, was an eisenkarbidhaltigen Nanodrähten und Kohlenstoffnanoröhrchen lag.
Zwar war der Japaner Norio Taniguchi im Jahre 1974 der Erste, der den Begriff „Nanotechnologie“ benutzte, doch als Vater der Nanotechnologie gilt der Physik-Nobelpreisträger Richard Feynman. In einer berühmt gewordenen Rede vom Dezember 1959 hatte er bereits bahnbrechende Ideen geäußert – etwa die Miniaturisierung von Computern, die Reduktion von Objektgrößen mit der damit einhergehenden Änderung von physikalischen Gesetzmäßigkeiten sowie die Komprimierung der 24 Bände umfassenden Encyclopedia Britannica auf einen Nagelkopf, wenn es möglich wäre, mit einzelnen Atomen die Buchstaben zu schreiben. Außerdem stellte er die wegweisende Frage, welche Eigenschaften Materialien hätten, wenn man ihre Atome den eigenen Wünschen gemäß anordnen könnte. Diese Denkrichtung führte zu komplett neuen Funktionalitäten und Designmöglichkeiten (siehe auch „Computer-basiertes Materialdesign“ auf Seite 87).
Während die Entwicklungen in der Nanotechnologie in 1970er-Jahren vor allem durch die Biotechnologie und Mikroelektronik geprägt waren, verlagerten sich die Schwerpunkte in den Achtzigerjahren auf die Materialforschung sowie die Informations- und Kommunikationstechnik. Mit Ende des 20. Jahrhunderts begann dann der Einzug der Nanotechnologie in viele Bereiche.
Magnetische Nanopartikel
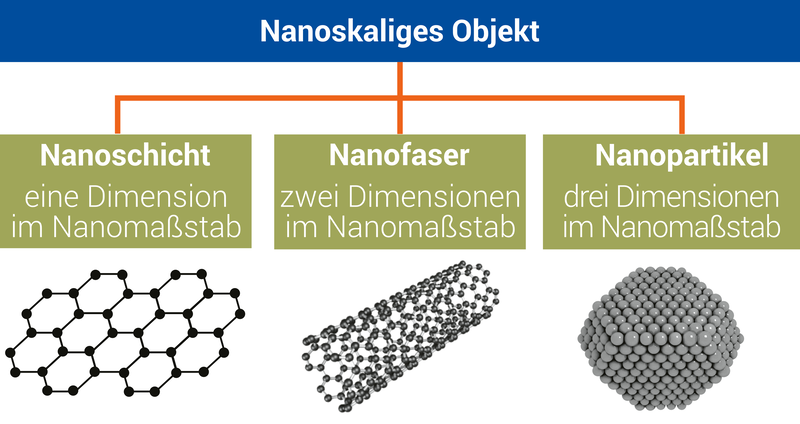
Alle Nanotechnologien basieren auf den Eigenschaften nanoskaliger Objekte. Beispiele hierfür sind Dünnschichtsysteme oder kleinste Partikel von weniger als 100 Nanometer Größe, die Nanopartikel. Durch das geringe Volumen bestimmt hier oft die Oberfläche das Verhalten: So liegen bei einem 10 nm großen Partikel rund 20% aller Atome an der Oberfläche, bei einem Durchmesser von 1 nm sind es schon bis zu 90% der Atome. Aus diesem Grund bilden Nanopartikel oft hervorragende Katalysatoren, z. B. im Abgassystem von Kraftfahrzeugen.
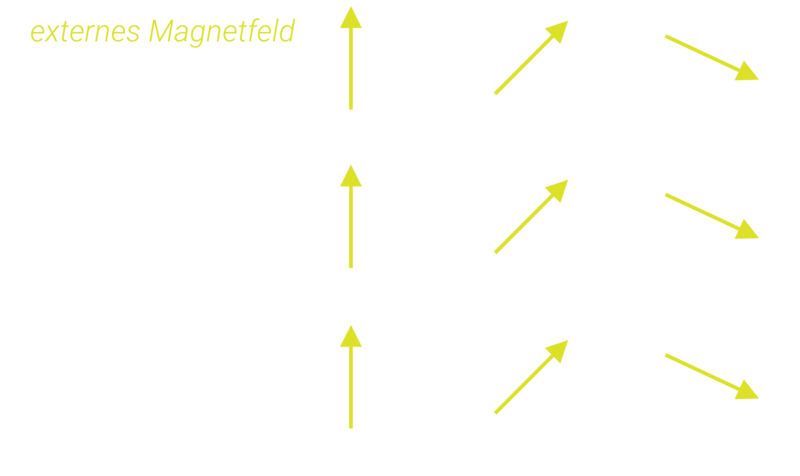
Aufgrund ihrer geringen Größe lassen sich Nanopartikel eher als große Moleküle denn als kleine Festkörper auffassen: Sie verlieren ihre klassischen makroskopischen Eigenschaften, stattdessen werden quantenphysikalische Phänomene relevant. So verhalten sich Nanopartikel aus Stoffen wie Eisen, Kobalt, Nickel oder Gadolinium, die als Festkörper „magnetisch“ sind, anders als ihre makroskopischen Konglomerate. Das Verhalten ist größenabhängig, weil die magnetischen Eigenschaften eines Objekts sich aus dem Zusammenspiel der magnetischen Momente seiner Bestandteile ergeben. Gibt es davon nur sehr wenige, so ist es für diese energetisch am günstigsten, wenn alle magnetischen Momente parallel ausgerichtet sind. Man sagt, es gibt nur noch eine Domäne. Die charakteristische Größe, unterhalb derer die Partikel eindomänig werden, liegt im Bereich von etwa 80 nm, hängt im Detail aber vom betrachteten Material ab. Diese eindomänigen Nanopartikel werden inzwischen in vielfältiger Weise in der Medizin eingesetzt. Voraussetzung dafür ist, dass sie keine unerwünschten Nebenwirkungen erzeugen, also biokompatibel sind. Bei Eisen ist das der Fall, da Eisen in sehr geringen Mengen auch im menschlichen Körper z. B. im Blutfarbstoff zu finden ist.
Herstellung von Nanopartikeln
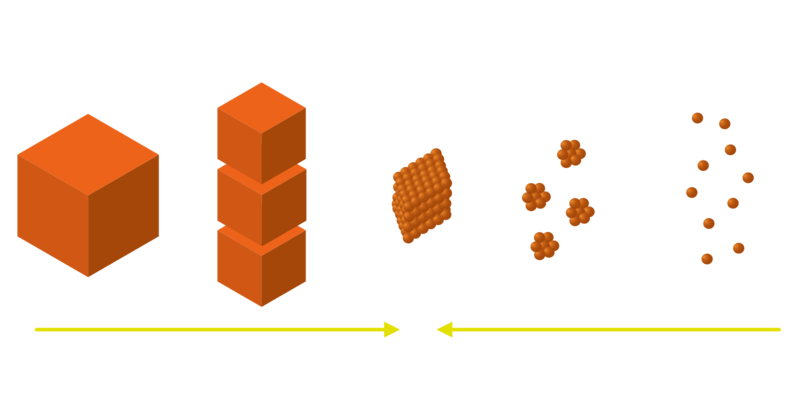
Es existieren zwei grundsätzlich unterschiedliche Herangehensweisen, um Nanomaterialien zu synthetisieren. Im Top-Down-Ansatz werden die nanoskaligen Objekte aus größeren Einheiten hergestellt, ohne dabei Kontrolle auf atomarer Ebene zu besitzen. Ein Beispiel dafür ist die Herstellung von Graphen aus Grafit. Die Bottom-Up-Strategie verfolgt im Gegensatz dazu das Ziel, durch einen kontrollierten Aufbau aus einzelnen Atom- und Molekülaggregaten größere Systeme wie Nanopartikel herzustellen – so wie aus einzelnen Bausteinen größere Modelle erzeugt werden können.
Mit Nanokurieren zum Ziel
Gegenwärtig erreicht nur weniger als ein Prozent der eingenommenen Medikamente ihren tatsächlichen Wirkungsort, was zu großen Nebenwirkungen und begrenzter Wirksamkeit führt. Magnetische Nanopartikel lassen sich als zuverlässige Medikamentenkuriere einsetzen, indem sie mithilfe eines äußeren Magnetfelds im Körper gelenkt werden und an ihnen gebundene Medikamente direkt zu ihrem Einsatzort bringen können. Das kann die Therapie deutlich verbessern und gesunde Zellen schonen – etwa bei der Chemotherapie.
Auch bei einer anderen vielversprechenden Tumortherapie werden Nanopartikel verwendet: Es werden dabei magnetische Nanopartikel in den Tumor eingebracht und anschließend durch ein von außen angelegtes magnetisches Wechselfeld induktiv erwärmt. Zwei Mechanismen tragen zur Erwärmung bei: Bei der Néel-Relaxation dreht sich durch die Oszillation des Magnetfelds nicht der Partikel selbst, sondern die Magnetisierungsrichtung innerhalb des Partikels. Das benötigt Energie, die dann abgegeben wird. Bei der Brown-Relaxation rotiert hingegen das gesamte Partikel, und die Energie wird über Reibung an die Umgebung abgegeben. Die Krebszellen werden auf diese Weise thermisch abgetötet, ohne anderes Gewebe in Mitleidenschaft zu ziehen. Um die Nanopartikel in das Zielgewebe zu transportieren, können sie entweder direkt in den Tumor oder in die den Tumor versorgende Arterie injiziert werden. Eine weitere Möglichkeit ist es, spezielle Moleküle, die spezifisch am Tumorgewebe binden, auf der Partikeloberfläche zu fixieren und durch die Blutbahn zu schicken.
Magnetische Nanopartikel können darüber hinaus die Bildgebung bei der Magnetresonanztomografie (MRT) verbessern. MRT basiert auf der magnetischen Anregung der sich im Körper befindenden Wasserstoffatome. Dies funktioniert, weil die Wasserstoffkerne (Protonen) aufgrund ihres Spins selbst ein magnetisches Moment haben. Für ein MRT werden ein sehr starkes konstantes Magnetfeld sowie überlagerte kleinere gepulste Magnetfelder benötigt. Die Bildgebung basiert auf Effekten, die mit der sogenannten Relaxation der Protonenspins nach der Anregung zu tun haben. Magnetische Nanopartikel beeinflussen das lokale Magnetfeld, in dem sich die Protonen befinden, und damit deren Relaxationen. Das kann die Kontraste im Signal des MRT deutlich verstärken.
Künstliches Fieber zur Krebsbekämpfung
Bei der Hyperthermie wird Gewebe auf Temperaturen von über 40 °C erwärmt. Es bietet eine vielversprechende Ergänzung zu den Standardtherapieformen. Dabei wird in den betroffenen Zellen entweder idealerweise direkt der programmierte Zelltod aktiviert oder die Empfindlichkeit für andere Therapien gesteigert. Im simultanen Einsatz mit einer Chemo- oder Strahlentherapie werden so nicht nur die Erfolgsaussichten der Behandlung verbessert, sondern auch die Nebenwirkungen der verwendeten Therapie verringert. In der medizinischen Anwendung gibt es unterschiedliche Verfahren: Bei der Ganzkörperhyperthermie wird der gesamte Körper erwärmt, um bereits gestreute Krebserkrankungen im gesamten Körper simultan zu behandeln. Dieses Verfahren belastet den Organismus enorm. Patient:innen befinden sich unter Vollnarkose oder tiefer Betäubung und müssen intensivmedizinisch überwacht werden, während ihr Körper einer Art künstlichem Fieber ausgesetzt wird. Mit der lokalen Oberflächenhyperthermie lässt sich Gewebe durch äußere Bestrahlung mit Ultraschall oder Mikrowellen erwärmen, etwa bei oberflächlichen Metastasen oder dicht unter der Oberfläche liegenden Tumoren. Bei der interstitiellen Hyperthermie werden die Wärmequellen in Körperöffnungen direkt am Tumor angebracht, um eine punktuelle Übererwärmung zu erreichen.